
Teori Asam Dan Basa Menurut Arrhenius Sexiz Pix
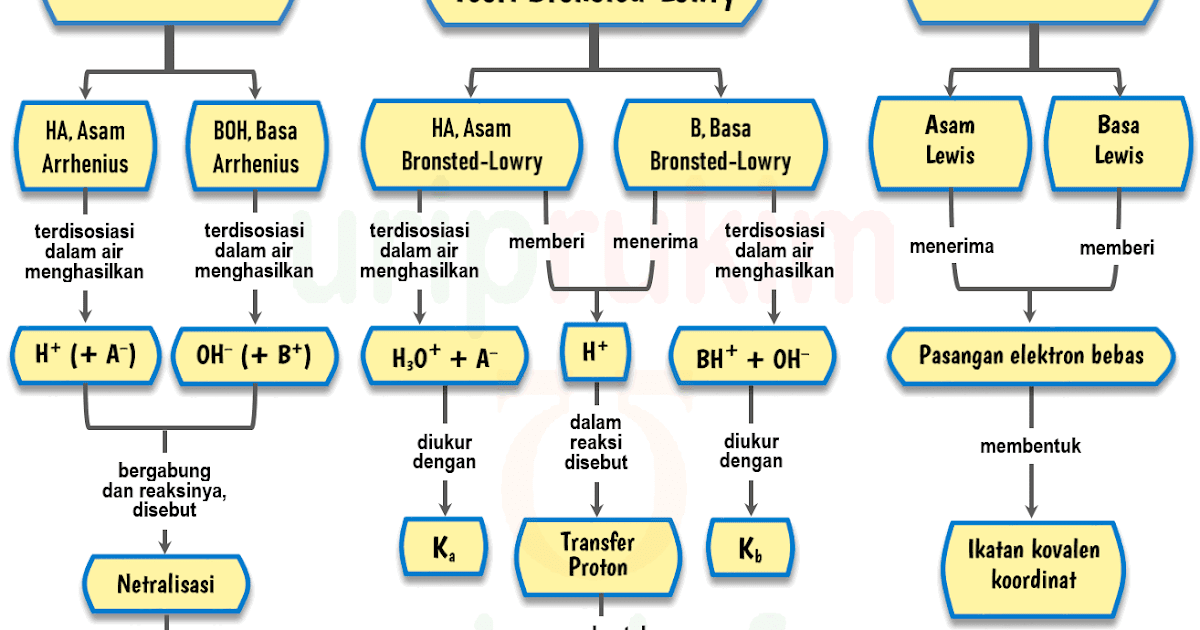
Dengan kata lain, amonia bertindak sebagai basa dengan cara menerima satu ion hidrogen dari asam. Karena proton selalu dihasilkan menurut teori asam-basa Arrhenius, berarti semua reaksi asam-basa Arrhenius merupakan reaksi asam-basa Bronsted-Lowry, dengan catatan, air terlibat dalam reaksi.

diantara senyawa berikut yang bersifat asam menurut Arrhenius adalah YouTube
Pengertian Asam Menurut Arrhenius. Dalam ilmu kimia, asam adalah salah satu jenis senyawa kimia yang memiliki sifat-sifat khas. Menurut teori Arrhenius, asam adalah senyawa kimia yang dapat membebaskan ion hidrogen (H+) ketika larut dalam air. Teori ini dikemukakan oleh ahli kimia Swedia bernama Svante Arrhenius pada akhir abad ke-19.

Asam Basa Arrhenius Bagian 1 (Definisi Asam Basa) Materi Larutan Asam Basa Kimia SMA Pojan
Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam.

TEORI ASAM BASA ARRHENIUS
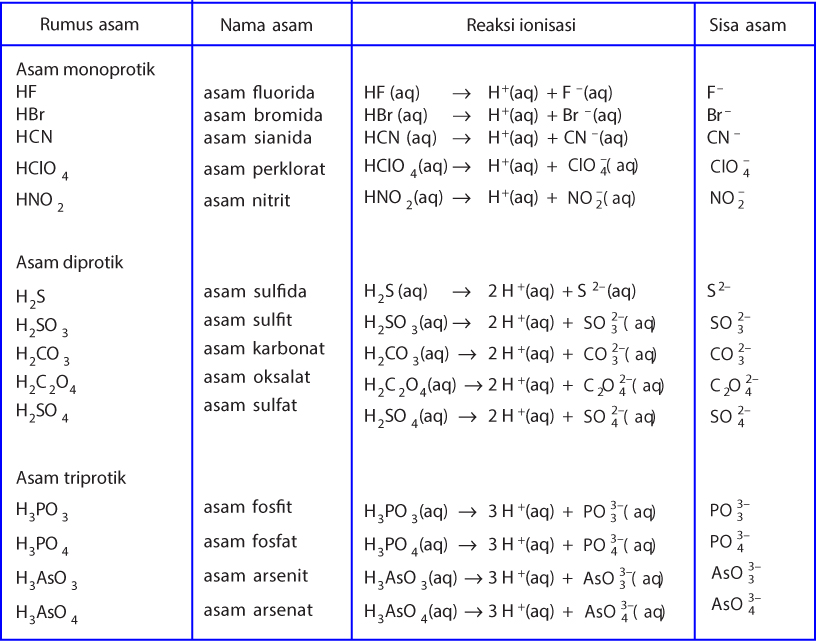
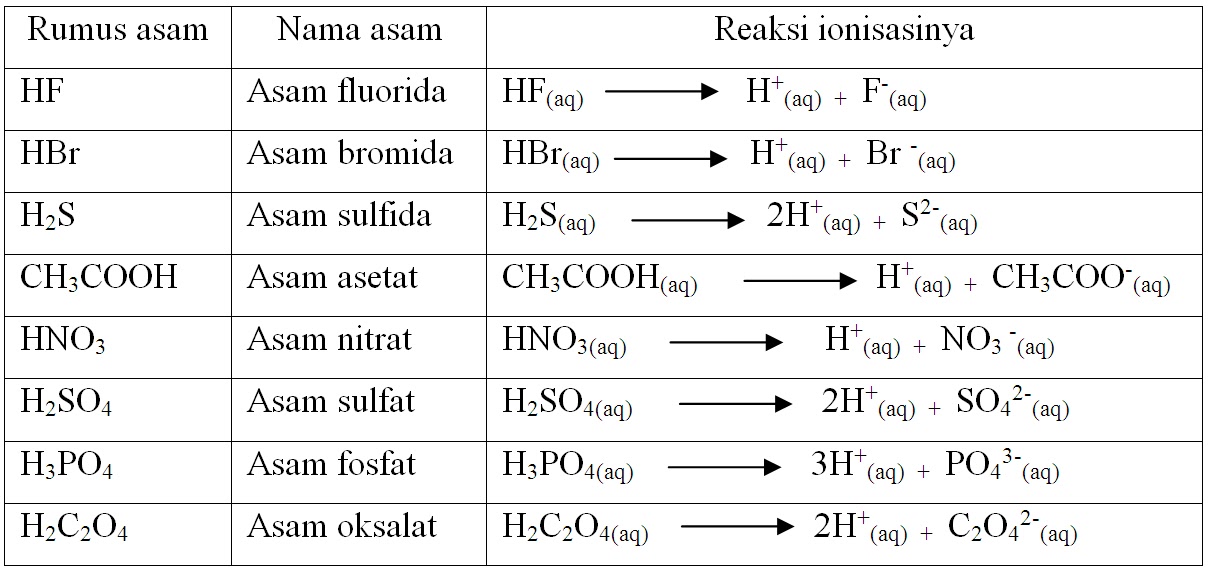
Menurut teori Arrhenius, asam Arrhenius merupakan zat yang jika dilarutkan dalam air, maka air tersebut akan menghasilkan ion H+ dalam larutan tersebut. Contohnya adalah ketika asam klorida atau HCI serta asam asetat atau CH3COOH dilarutkan, dengan persamaan reaksi yang terjadi dari asam klorida serta asam asetat sebagai berikut.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Teori Asam dan basa Menurut Arrhenius. Pada tahun 1884, Svante Arrhenius (1859-1897) seorang ilmuwan Swedia yang memenangkan hadiah nobel atas karyanya di bidang ionisasi, memperkenalkan pemikiran tentang senyawa yang terpisah atau terurai menjadi bagian ion-ion dalam larutan.. Salah satu definisi basa adalah zat yang jika dilarutkan di.

Konsep Asam Basa kimia A. Konsep Asam Basa Teori Asam Basa a. Teori Arrhenius Menurut
2. Teori Asam Basa Arrhenius. Pada tahun 1884, Svante August Arrhenius mengemukakan teori asam basa ini. Definisi asam basa menurut Arrhenius seperti ini: Asam adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion H +. Basa adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion OH -.

Teori Asam Basa
Menurut Arrhenius asam adalah senyawa yang meningkatkan konstentrasi H+ dalam larutan berair. Artinya, asam Arrhenius adalah senyawa yang menghasilkan ion hidrogen (H+). Ketika suatu zat dilarutkan dalam air. Jika zat tersebut menghasilkan ion H+, berarti zat tersebut adalah asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Rumusan umum untuk reaksi asam-basa menurut definisi Brønsted-Lowry adalah: HA + B → BH + + A −. dalam reaksi di atas, HA mewakili asam, B mewakili basa, BH + mewakili asam konjugasi dari B, dan A − mewakili basa konjugasi dari HA. Air bersifat amfoterik—yaitu, ia dapat bertindak sebagai asam dan basa.

TEORI ASAM BASA Teori Arrhenius Dasar teorinya adalah
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.

Definisi Asam Menurut Arrhenius Adalah
Arrhenius: Menurut definisi ini, asam adalah suatu zat yang meningkatkan konsentrasi ion hidronium (H 3 O +) ketika dilarutkan dalam air. Definisi yang pertama kali dikemukakan oleh Svante Arrhenius ini membatasi asam dan basa untuk zat-zat yang dapat larut dalam air. Brønsted-Lowry: Menurut definisi ini, asam adalah pemberi proton kepada basa.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori Asam Basa Menurut Ahli. Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya. Teori Asam Basa Arrhenius. Svante Arrhenius adalah seorang ilmuwan asal Swedia yang telah berhasil mengemukakan teori asam dan basa pada tahun.

Chocogreentea Kelemahan Teori Asambasa Arrhenius
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.. Asam basa Arrhenius menyatakan bahwa asam adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H + dalam larutan dan basa adalah zat yang.
Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.

Detail Contoh Teori Asam Basa Arrhenius Koleksi Nomer 16
Karakteristik Asam Menurut Teori Arrhenius. Menurut teori Arrhenius, terdapat beberapa karakteristik yang dapat mengidentifikasi asam. Berikut adalah beberapa ciri-ciri asam menurut teori ini: 1. Rasa Asam. Asam memiliki rasa asam yang khas. Contohnya, asam sitrat yang terdapat dalam buah lemon memberikan sensasi asam yang segar saat dikonsumsi. 2.
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
Pengertian asam Dikutip dari laman emodul Kemdikbud, pengertian asam menurut Svante August Arrhenius, seorang ahli kimia asal Swedia yang hidup tahun 1859-1927 adalah semua zat yang jika dilarutkan dalam air akan terurai menghasilkan ion H+. Misalnya hidrogen klorida (HCL) jika dilarutkan dalam air akan menjadi ion H+ dan ion Cl-.